وبلاگ
شیوه کارکرد باتری ها چگونه است؟
-
 یو پی اس کاران
یو پی اس کاران - دسته بندی : مقالات انرژی, مقالات تخصصی باتری یو پی اس
- No Comments

راهنمای مطالعه
در این مقاله از یو پی اس کاران قصد داریم نحوه عملکرد باتری را به زبان ساده تشریح کنیم و به این سوال پاسخ دهیم که باتری ها چطور کار می کنند؟ پس اگر شما هم قصد تحقیق درباره شیوه کارکرد باتری ها را دارید حتما تا پایان این مقاله با ما همراه باشید.
در واقع باتری ساعت، باتری لپتاپ یا باتری موبایلی که هم اکنون احتمالا با آن در حال خواندن این تحقیق هستید همگی از یک چیز تغذیه میکنند: از شیمی! بله درست است از شیمی باتری ها در واقع یکی از متحول کننده ترین و بزرگترین موفقیت های علمی بشر هستند و تمام آن آینده ای که نسل بشر برای رسیدن و زندگی کردن در سیارات دیگر، استفاده از ربات ها، ماشین های الکتریکی، و استفاده از انرژی خورشید و باد برای خود در نظر گرفته فقط با کمک باتری ها ممکن خواهد بود.
انواع مختلفی از باتری ها وجود دارد، اما همه آنها بر اساس یک مفهوم اساسی کار می کنند. به نقل از آنتونی آلانور دانشیار فوق دکتری در بخش علوم و مهندسی مواد دانشگاه MIT: باتری وسیله ای است که می تواند انرژی الکتریکی را به شکل انرژی شیمیایی در خود ذخیره کرده و زمانی که به آن نیاز داریم آن را به الکتریسیته تبدیل کند. در واقع شما نمی توانید برق را بگیرید و در جایی ذخیره کنید تا بصورت پرتابل از آن استفاده کنید، اما می توانید انرژی الکتریکی را در مواد شیمیایی درون باتری ها ذخیره کرده و در جایی که نیاز دارید آن را به الکتریسیته تبدیل کنید. این اتفاقی است که هر روزه در تمام باتری هایی که استفاده می کنید رخ می دهد.
یک لحظه دنیا را بدون وجود باتری ها تصور کنید. هیچکدام از دستگاه ها و گدجت های قابل حملی که از آنها استفاده می کنیم وجود نخواهند داشت! ما فقط میتوانیم لپتاپها و تلفنهای خود را تا جایی که کابل برق آنها اجاره می دهد جابجا کنیم و تجهیزاتی مثل جی پی اس اصلا وجود نخواهند داشت.
خوشبختانه امروزه باتری ها را داریم و می بینیم که مسیر پیشرفت آینده بشر مثل اکتشافات علمی و سکونت روی سیاره های دیگر و سفر در فضا فقط با پیشرفته تر شدن باتری ها ممکن خواهد شد. در واقع پروژه های اصلی شرکت های بزرگ فن آوری مثل شرکت تسلا، اسپیس ایکس و ناسا انجام می شود کار کردن و تحقیق بر روی بهینه تر کردن باتری ها هست.
باتری وسیله ای است که انرژی شیمیایی را ذخیره و زمانی که به آن نیاز داریم به انرژی الکتریکی تبدیل می کند.
آنتونی آلانور - دانشگاه MIT
برای بررسی شیوه کارکرد باتری ها بیایید با قدیمی ترین باتری کشف شده تاریخ شروع کنیم، باستان شناسان حدود 80 سال پیش در سایت باستان شناسی “خوجوت رابه” (Khujut Rabu) در نزدیکی شهر بغداد کنونی، کوزه های سفالی تخم مرغ شکلی را در یک مقبره باستانی پیدا کرده اند که بعد از بررسی، به این نتیجه رسیدند که این کوزه های باستانی دقیقا کارکرد باتری های امروزی را دارند.
طبق یافته های باستان شناسان، این کوزه ها مربوط به 150 سال قبل از میلاد مسیح و در دوره اشکانیان (پارت ها) ساخته شده اند، طرز کار این باتری های باستانی که به باتری بغداد یا پیل اشکانی معروف شدند به این صورت است فضای داخلی کوزه با استفاده از قیر عایق کاری شده و یک استوانه مسی که یک میله آهنی درون آن و بدون برخورد با مس قرار داده شده است که به عنوان الکترود عمل می کرده اند و از یک ماده اسیدی مثل سرکه یا شراب به عنوان الکترولیت استفاده می شده است.
باستان شناسان معتقدند که این باتری ها توسط ایرانیان آن زمان در مراسم مذهبی و همچنین آبکاری مجسمه ها و اجسام با طلا و نقره استفاده می شده است.

اختراع باتری به شکل کنونی به دانشمند ایتالیایی الساندرو ولتا نسبت داده می شود، در سال 1800 ولتا اولین باتری را برای اثبات نظریه خود به یک دانشمند ایتالیایی دیگر به نام لوئیجی گالوانی در آزمایشگاه ساخت. او یافتههای خود را در نامهای به جوزف بنکس، رئیس وقت انجمن سلطنتی علوم انگلستان در سال 1800 شرح داد. بعدها واحد پتانسیل الکتریکی ( ولت ) به نام او نامگذاری شد.
باتریهای موجود در بازار دارای انواع، اشکال و ابعاد گوناگونی هستند، از باتریهای سنگین سرب اسیدی گرفته تا مدلهای بسیار کوچک که در سمعک ها و تجهیزات شنوایی استفاده میشوند. تمام انواع این باتریها، اجزا و عملکرد شیمیایی مشابهی دارند که در ادامه به آن می پردازیم.
در ادامه برای درک بهتر اینکه باتری ها چطور کار می کنند؟ دعوت می کنیم، این ویدیو که شیوه کارکرد باتری ها و همچنین داستان اختراع باتری، به شکل کنونی را توسیط الساندرو ولتا، به زبان ساده بیان می کند را ببینید.
سه جزء اصلی در هر باتری
سه جزء اصلی در هر باتری، دو الکترود فلزی از دو جنس مختلف، و یک الکترولیت است. الکترولیت، ضمن جدا کردن الکترودها از یکدیگر، امکان جاری شدن انرژی میان الکترودها را نیز فراهم میآورد.
سه جزء اصلی یک باتری وجود دارد: دو پایانه ساخته شده از مواد شیمیایی مختلف (معمولاً فلزات)، آند و کاتد. و الکترولیت که این پایانه ها را جدا می کند. الکترولیت یک محیط شیمیایی است که اجازه می دهد بار الکتریکی بین کاتد و آند جریان یابد. هنگامی که یک دستگاه به یک باتری – یک لامپ یا یک مدار الکتریکی – متصل می شود، واکنش های شیمیایی روی الکترودها رخ می دهد که جریان انرژی الکتریکی را به دستگاه ایجاد می کند.
اگرچه، این جریان تنها زمانی اتفاق میفتد که یک جریان الکتریسیته متناوب بین الکترودها و یک دستگاه خارجی وجود داشته باشد. اساس کارکرد تمام باتریها، از جمله باتری یو پی اس همین است، اگرچه نکات دیگری نیز برای عنوان کردن وجود دارد. الکترود منفی، کاتود، و الکترود مثبت، آنود نامیده میشوند. انرژی در الکترونها و یونهایی که بین این دو در حرکت هستند، وجود دارد.

🔋 سه جزء اصلی در هر باتری عبارتند از دو الکترود فلزی از جنس های مختلف و یک الکترولیت است.
شیمی باتری
باتری وسیله ای است که انرژی شیمیایی را درون خود ذخیره کرده و آن را به الکتریسیته تبدیل می کند. این فرآیند به عنوان الکتروشیمی شناخته می شود، کوچکترین جزء هر باتری سلول الکتروشیمیایی نامیده می شود. یک باتری می تواند از یک یا چند سلول الکتروشیمیایی تشکیل شده باشد. هر سلول الکتروشیمیایی از دو الکترود تشکیل شده است که توسط یک الکترولیت از هم جدا شده اند.
بنابراین یک سلول الکتروشیمیایی الکتریسیته خود را از کجا تامین می کند؟ برای پاسخ به این سوال باید بدانیم برق چیست. ساده تر، الکتریسیته نوعی انرژی است که توسط جریان الکترون ها تولید می شود. در یک سلول الکتروشیمیایی، الکترون ها توسط یک واکنش شیمیایی تولید می شوند که در یک الکترود اتفاق می افتد (در مورد الکترودها در زیر بیشتر توضیح می دهیم!) و سپس به سمت الکترود دیگر جریان می یابند که در آنجا مصرف می شوند. برای درک درست این موضوع، باید نگاه دقیقتری به اجزای سلول و نحوه کنار هم قرار دادن آنها داشته باشیم.
الکترود باتری چیست
برای تولید جریان، الکترون ها باید جایی را داشته باشند که حرکت خود را از آن شروع کرده و جایی را هم داشته باشند که به آنجا بروند. در این صورت است که جریان الکترونها شکل پیدا خواهد کرد. در یک باتری، الکترون ها از یک الکترود به نام آند (یا الکترود منفی) به الکترود دیگر، به نام کاتد (الکترود مثبت) جریان پیدا می کنند. الکترود ها، معمولاً دو نوع مختلف فلزی یا سایر ترکیبات شیمیایی جدیدتر هستند.
در پیل ولتا، آند (یا الکترود منفی) از جنس روی بود که از آن الکترونها از طریق سیم (در صورت اتصال) به نقره که کاتد باتری بود، جریان پیدا میکرد. ولتا تعداد زیادی از این سلول ها را روی هم چید تا پیل خود را بسازد و ولتاژ را افزایش دهد.
اما در وهله اول آند باتری، این همه الکترون را از کجا می آورد؟ و چرا این الکترون ها به سمت کاتد حرکت می کنند؟ جواب همه این ها به شیمیای برمیگردد که در داخل سلول باتری در هر روزه اتفاق می افتد. در مورد نحوه عملکرد باتری ها باید چند واکنش شیمیایی را درک کنیم. در آند باتری، الکترود با الکترولیت واکنش نشان داده و الکترون تولید می کند. این الکترون ها در آند جمع می شوند. در همین حال، در کاتد، واکنش شیمیایی دیگری به طور همزمان رخ می دهد که الکترود را قادر می سازد تا الکترون ها را بپذیرد.
اصطلاح شیمیایی فنی برای واکنشی که شامل تبادل الکترون است، یک واکنش کاهش-اکسیداسیون است که معمولاً واکنش ردوکس redox reaction نامیده می شود. کل واکنش را می توان به دو نیم واکنش تقسیم کرد و در مورد یک سلول الکتروشیمیایی، یک نیم واکنش در آند و دیگری در کاتد رخ می دهد. کاتد الکترون ها را بدست میاورد و آند الکترون ها را از دست می دهد.
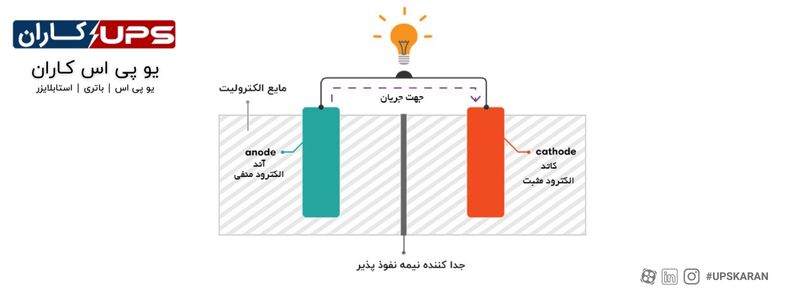
در واقع هر دو ماده رسانا که بتواند با الکترولیت واکنش نشان دهد میتوانند به عنوان الکترولیت استفاده شوند، زیرا فلز قویتر میتواند الکترونها را از فلز ضعیفتر بگیرد. اما انتخاب ایده آل برای آند، ماده ای است که واکنشی بسیار کمتر (منفی تر) نسبت به ماده ای که برای کاتد انتخاب می کنید، ایجاد کند. چیزی که در نهایت به آن میرسیم این است که الکترونها از آند به کاتد حرکت می کنند و زمانی که یک سیم رسانا بین این دو قرار داشته باشد می توانیم از این انرژی الکتریکی در وسایل الکتریکی مختلف استفاده کنیم.
اختلاف پتانسیل بین الکترودهای یک باتری برابر با نیرویی است که الکترون ها بین دو الکترود حرکت می کنند. این انرژی به عنوان پتانسیل الکتروشیمیایی کلی باتری شناخته می شود و ولتاژ هر سلول باتری را تعیین می کند. هرچه این اختلاف بیشتر باشد پتانسیل الکتروشیمیایی باتری بیشتر بوده و ولتاژ تولید شده باتری بالاتر است.
برای افزایش ولتاژ باتری، دو گزینه داریم. ما میتوانیم مواد مختلفی را برای الکترودهای خود انتخاب کنیم، موادی که پتانسیل الکتروشیمیایی بیشتری به سلول میدهند. یا، می توانیم چندین سلول باتری را در کنار هم قرار دهیم. هنگامی که سلول ها به به صورت سری در کنار همدیگر قرار گیرند، ولتاژ باتری اضافه می شود. اساساً، نیرویی که در آن الکترونها از طریق باتری حرکت میکنند را میتوان بهعنوان نیروی کل در حین حرکت از آند سلول اول در تمام طول مسیر از طریق سلولهای زیادی که باتری دارد تا کاتد سلول نهایی مشاهده کرد.
هنگامی که سلولهای باتری به روش موازی در کنار همدیگر قرار گیرند، جریان باتری را افزایش میدهد، که میتوان آن را به عنوان تعداد کل الکترونهایی در نظر گرفت که در سلولها جریان دارند.
الکترولیت باتری چیست
اما الکترودها فقط بخشی از باتری هستند بخش مهم دیگر هر باتری الکترولیت است. یک الکترولیت می تواند یک مایع، ژل یا یک ماده جامد باشد، الکترولیت باتری باید بتواند براحتی اجازه حرکت یون های باردار را بدهد. یکی از باتری های پر مصرف در صنایع مختلف باتری های ژل اسید هستند که این دسته بندی بر حسب نوع الکترولیت این باتری که بصورت ژل است می باشد.
الکترون ها دارای بار منفی هستند و از آنجایی که ما در هر مدار الکتریکی جریانی از الکترون های منفی را داریم که حرکت می کنند، به روشی برای متعادل کردن حرکت بار نیاز داریم. الکترولیت محیطی را فراهم می کند که از طریق آن یون های مثبت که متعادل کننده بار هستند می توانند جریان داشته باشند.
همانطور که واکنش شیمیایی در آند باعث تولید الکترون می شود، برای حفظ تعادل بار خنثی روی الکترود، مقدار منطبقی از یون های دارای بار مثبت نیز تولید می شود. اینها از طریق مدار خارجی باتری حرکت نمی کنند (این فقط برای الکترون ها است!) بلکه در الکترولیت آزاد می شوند.
در عین حال، کاتد همچنین باید بار منفی الکترونهایی را که دریافت میکند متعادل کند، بنابراین واکنشی که در اینجا رخ میدهد باید یونهای دارای بار مثبت را از الکترولیت به داخل جذب کند (در روش دیگر، ممکن است یونهای بار منفی از الکترود به الکترولیت آزاد شود).
بنابراین، در حالی که مدار خارجی مسیر جریان الکترون های با بار منفی را فراهم می کند، الکترولیت مسیری را برای انتقال یون های با بار مثبت برای متعادل کردن جریان منفی فراهم می کند. این جریان یونهای مثبت به همان اندازه جریان الکترونها در مدار خارجی که برای تامین انرژی دستگاههای خود استفاده میکنیم، مهم هستند و در واقع این نقش متعادل کننده بار که آنها انجام می دهند برای اجرای کل واکنش در هر باتری ضروری است.
حال، اگر به تمام یون های آزاد شده در الکترولیت اجازه داده شود که کاملا آزادانه در الکترولیت حرکت کنند، در نهایت سطوح الکترودها را می پوشانند و کل سیستم را مسدود می کنند. بنابراین سلول معمولاً نوعی مانع برای جلوگیری از این اتفاق دارد.
هنگامی که از باتری استفاده می شود، وضعیتی داریم که در آن جریان پیوسته الکترون ها (از طریق مدار خارجی) و یون های دارای بار مثبت (از طریق الکترولیت) وجود دارد. اگر این جریان پیوسته متوقف شود – اگر مدار باز باشد، مانند زمانی که مصرف کننده یا لامپ خاموش است – جریان الکترون ها متوقف می شود. بارها انباشته/جمع میشوند و واکنشهای شیمیایی که باتری را هدایت میکنند متوقف میشوند.
در زمان استفاده طولانی مدت از باتری، و واکنشهای زیاد در هر دو الکترود، مواد شیمیایی جدیدی درون باتری ساخته میشوند. این مواد شیمیایی می توانند نوعی مقاومت داخلی درون باتری ایجاد کنند که می تواند از ادامه واکنش داخلی باتری با همان کارایی قبلی جلوگیری کند. وقتی مقاومت داخلی باتری خیلی زیاد شود، واکنش های داخلی آن کند می شود و حرکت الکترون ها بین کاتد و آند نیز قدرت خود را از دست می دهد و جریان الکترون ها متوقف می شود و باتری کم کم خالی می شود.
چگونگی حرکت الکترونها بین دو الکترود در باتری
فرض کنیم باتری در وضعیت شارژ قرار دارد. زمانی که آن را به یک دستگاه خارجی متصل میکنیم، مواد شیمیایی موجود در آنود، الکترونها را به پایانه منفی ارسال میکنند و یونها بهواسطه الکترولیت عبور میکنند. در همین زمان، کاتود در پایانه مثبت، این الکترونها را دریافت کرده و در نتیجه، جریان آنها را تکمیل میکند.
این نحوه کارکرد تمام باتریها، صرفنظر از نوع، شکل و ابعاد آنهاست. یونها انرژی را به واسطه الکترولیت دریافت میکنند. در حالی که الکترونها در قالب الکتریسیته در مدار خارجی جاری میشوند، و بدین طریق جریان الکتریکی تولید میکنند. بعضی از باتریها یک بار مصرف هستند، که در این صورت پس از تمام شدن مواد تشکیلدهنده آنها تنها برای بازیافت کاربرد دارد.
شارژ مجدد باتری
تعدادی زیادی از باتری های معمولی فقط یک بار مصرف هستند. حرکت الکترون ها از آند به کاتد یک طرفه است. یا با آزاد کردن یونهای مثبت یا منفی خود در الکترولیت، الکترودهای آنها تخلیه میشوند، یا تجمع محصولات واکنش روی الکترودها از ادامه واکنش جلوگیری میکند و باتری دیگر قادر به تولید کردن جریان نیست. باتری های یکبار مصرف در نهایت به سطل زباله انداخته می شوند و یا بازیافت می شوند.
ولی. نکته جالب در مورد جریان یونها و الکترونها در برخی از انواع باتریها که دارای مواد الکترود مناسب هستند، این است که میتواند به عقب برگردد و باتری ما را به نقطه شروعش برگرداند و به آن جان تازهای بدهد. . همانطور که باتری ها روش استفاده از دستگاه های الکتریکی مختلف را تغییر دادند، باتری های قابل شارژ نیز کاربرد و طول عمر آن دستگاه ها را تغییر دادند.
هنگامی که یک باتری تقریباً خالی را به یک منبع الکتریسیته خارجی وصل می کنیم و انرژی را به باتری می فرستیم، واکنش شیمیایی که در حین تخلیه باتری رخ داده است را معکوس می کنیم این کار یونهای مثبت آزاد شده از آند را به داخل الکترولیت به آند میفرستد و الکترونهایی را که کاتد وارد میکند نیز به آند بازمیگرداند. بازگشت یونهای مثبت و الکترونها به آند، سیستم را آغاز میکند تا دوباره آماده کار شود و باتری شما دوباره شارژ میشود.
تعداد بسیار زیادی از باتریها، بهواسطه معکوس کردن جریان یونها از طریق الکترولیت، قابلیت شارژ مجدد دارند. باتری های ماشین، باتری های یو پی اس و تلفن های همراه و خیلی از لوازم دیگری که بصورت روزانه از آنها استفاده می کنیم دارای باتری های قابل شارژ هستند.
سوالات متداول
پر تکرار ترین سوالات در مورد شیوه کارکرد باتری ها
تمام باتری ها دارای سه جزء اصلی بنام آند، کاتد و الکترولیت هستند.
باتری ها انرژی الکتریکی را به شکل انرژی شیمیایی در خود ذخیره کرده و زمانی که به آن نیاز داریم آن را به الکتریسیته تبدیل کند.

یو پی اس کاران
فروشگاه تخصصی یو پی اس UPS و باتری یو پی اس


[ پربحث ترین مطالب ]
[ آخرین مطالب ]























